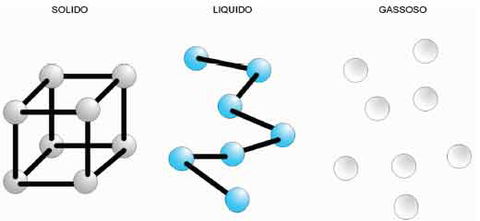
Si definisce solida una sostanza che, grazie ad un alto grado di coesione delle sue molecole, mantiene la propria forma (figura 4). È liquida una sostanza costituita da molecole con un basso grado di coesione, cioè libere di scorrere le une sulle altre, e che prende quindi la forma del recipiente che la contiene.
È allo stato gassoso (o aeriforme) una sostanza le cui molecole hanno perso qualsiasi grado di coesione divenendo libere di muoversi nello spazio, al punto tale che la sostanza deve essere “imprigionanata” in un recipiente chiuso, altrimenti sfuggirebbe in atmosfera.
Somministrando calore ad un corpo si aumenta il moto molecolare fino a portarlo al cambiamento di stato (da solido a liquido e/o da liquido a gas), mentre sottraendo calore si rallenta il moto molecolare fino a portarlo al cambiamento di stato inverso (da gas a liquido e/o da liquido a solido). L’esempio più a portata di mano è l’acqua (stato liquido), che allo stato solido è ghiaccio mentre allo stato gassoso è vapore acqueo. Somministrando calore ad un cubetto di ghiaccio provochiamo la fusione dello stesso e quindi il passaggio dallo stato solido allo stato liquido; continuando la somministrazione di calore possiamo provocare un ulteriore cambiamento di stato da liquido a gassoso (vapore d’acqua). Alla pressione atmosferica di 1013 mbar, per portare un kilogrammo di ghiaccio da -20°C fino allo stato di vapore a 120° C, la quantità di calore in gioco è variabile, come indicato di seguito:
- 10 kcal circa sono necessarie per portare il ghiaccio da -20°C a 0°C
- 80 kcal circa sono necessarie per sciogliere il ghiaccio (0°C)
- 100 kcal circa sono necessarie per raggiungere la temperatura di ebollizione di 100°C
- 539 kcal circa sono necessarie per evaporare totalmente l’acqua (cambiamento di stato da 100°C liquido a 100°C vapore)
- 9 kcal circa sono necessarie per portare il vapore fino a 120°C (surriscaldato di 20°C).
Come si può facilmente vedere, la maggior quantità di calore è stata spesa per effettuare il cambiamento di stato da liquido a gassoso, che avviene a temperatura costante: temperatura determinata dalla pressione atmosferica gravante sull’acqua presa in considerazione. Infatti, se diminuisce la pressione diminuisce il punto di ebollizione (o evaporazione), cioè nella fase di cambiamento di stato esiste una precisa corrispondenza pressione/temperatura (tabella 2), al punto tale che misurando la pressione si può conoscere la temperatura o viceversa. Questa corrispondenza non esiste nella fase di riscaldamento o raffreddamento della materia, dove la somministrazione o la sottrazione di calore provoca un semplice cambiamento di temperatura. Quindi l’evaporazione di un liquido (cambiamento di stato da liquido a vapore) avviene con un forte scambio di calore e proprio questo fenomeno viene sfruttato nei sistemi split, dove nell’unità interna entra un gas refrigerante allo stato liquido, che, in certe condizioni di pressione, evapora ad una certa temperatura (da qui il nome evaporatore) grazie alla grossa quantità di calore sottratta all’aria ambiente, fatta circolare attraverso l’evaporatore stesso tramite un ventilatore. Questo ci permette di avere macchine dimensionalmente più piccole, ma “grandi” dal punto di vista della potenzialità frigorifera e quindi della capacità di assorbimento di calore dall’ambiente.
|
Tabella 2 - Temratura di ebollizione dell\'acqua alle varie quote s.l.m. | ||
|
Quota in m. sul livello del mare |
Pressione atmosferica in millibar |
Temperatura di ebollizione in °C |
|
0-1 Hz |
- |
2 x 105 |
|
-1000 |
1139 |
103 |
|
-500 |
1075 |
101,7 |
|
0 |
1013 |
100 |
|
500 |
955 |
98,3 |
|
1000 |
899 |
96,7 |
|
1500 |
846 |
95,2 |
|
2000 |
795 |
93,4 |
|
2500 |
747 |
91,6 |
|
3000 |
701 |
89,9 |
|
3500 |
658 |
88,4 |
|
4000 |
616 |
86,7 |
|
4500 |
577 |
85 |
|
5000 |
541 |
83,4 |
|
5500 |
505 |
81,6 |
|
6000 |
472 |
79,9 |
|
6500 |
440 |
78,3 |
|
7000 |
410 |
76,5 |
|
7500 |
382 |
74,8 |
|
8000 |
356 |
73,1 |
|
8500 |
331 |
71,4 |
|
9000 |
307 |
69,7 |
|
9500 |
285 |
67,9 |
|
10000 |
264 |
66,3 |
Il sistema frigorifero, quindi, “non produce freddo”, ma sottrae calore al fluido (aria nel caso dello split) che deve trattare, producendo di conseguenza un abbassamento della temperatura del fluido stesso.